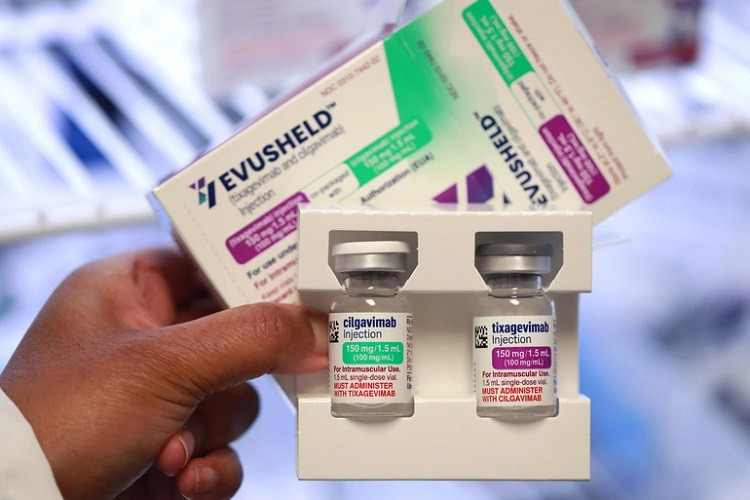
 |
Kết quả được công bố trên Tạp chí The Lancet Respiratory Medicine, chứng minh lợi ích của bộ đôi kháng thể này trong việc điều trị Covid-19 ngoại trú ở mức độ nhẹ đến trung bình. Kết quả chi tiết từ thử nghiệm điều trị ngoại trú TACKLE pha III cho thấy, so với giả dược, bộ đôi kháng thể đơn dòng Evusheld của AstraZeneca (kết hợp giữa tixagevimab và cilgavimab, trước đây là AZD7442) có tác dụng bảo vệ đáng kể về mặt thống kê và lâm sàng trong việc ngăn chặn các triệu chứng bệnh Covid-19 tiến triển nghiêm trọng hoặc tử vong do bất kỳ nguyên nhân nào. Đồng thời, việc sử dụng sớm hỗn hợp kháng thể này trong quá trình điều trị giúp đạt được các kết quả tích cực hơn.
TACKLE được thử nghiệm trên người lớn đang mắc Covid-19 ở mức độ nhẹ hoặc trung bình, không phải nhập viện và có biểu hiện triệu chứng trong 7 ngày trở xuống. Trong thử nghiệm, 90% người tham gia có nguy cơ Covid-19 tiến triển nghiêm trọng do các bệnh đồng mắc hoặc tuổi tác cao.
Ông Hugh Montgomery - Giáo sư Y khoa Chăm sóc Tích cực tại Đại học College London, Vương quốc Anh và là nghiên cứu viên chính của thử nghiệm TACKLE cho biết: “Mặc dù vaccine đã có nhiều thành công đáng kể nhưng những đối tượng như người lớn tuổi, những người có bệnh đồng mắc và những người bị suy giảm miễn dịch vẫn có nguy mắc Covid-19 nghiêm trọng. Cần có các giải pháp bổ sung để ngăn chặn sự tiến triển của bệnh và giảm gánh nặng cho hệ thống chăm sóc sức khỏe, đặc biệt là với sự xuất hiện liên tục của các biến thể mới. Kết quả TACKLE cho thấy rằng, một liều Evusheld tiêm bắp có thể ngăn chặn những tiến triển nghiêm trọng của Covid-19 trên những bệnh nhân này và sẽ có kết quả tốt hơn nếu được sử dụng sớm trong quá trình điều trị”.
Ông Mene Pangalos - Phó chủ tịch điều hành BioPharmaceuticals R&D tại AstraZeneca cho biết: “Bộ đôi kháng thể đơn dòng tác dụng kéo dài này đã có mặt tại Việt Nam từ tháng 3 vừa qua, cũng là một trong những nước châu Á đầu tiên. Thuốc này đã nhận được cấp phép nhập khẩu đặc biệt của Bộ Y tế. Nhiều nghiên cứu cho thấy Evusheld vẫn giữ vững khả năng bảo vệ trước tất cả biến thể Covid-19 đã được nghiên cứu tới nay, bao gồm cả Omicron”.
Hiện hỗn hợp kháng thể này đang được sử dụng tại Bệnh viện Đa khoa Tâm Anh Hà Nội và TP.HCM, sẽ sớm có mặt ở một số bệnh viện khác nhằm tăng cường khả năng tiếp cận cho người dân. Thuốc được chỉ định bởi bác sĩ dành cho mục đích dự phòng trước phơi nhiễm Covid-19 ở những nhóm bệnh nhân không thể tiêm vaccine hoặc đã tiêm nhưng không có đáp ứng miễn dịch đầy đủ.
Trong thử nghiệm TACKLE, so với giả dược, một liều tiêm bắp Evusheld 600mg giảm đáng kể nguy cơ tiến triển Covid-19 nặng hoặc tử vong (do bất kỳ nguyên nhân nào) tới 50% (khoảng tin cậy 95%, 15-71; p = 0,010) cho đến ngày thứ 29 đối với các bệnh nhân mắc Covid-19 từ nhẹ tới trung bình, không nhập viện và biểu hiện triệu chứng trong khoảng thời gian 7 ngày trở xuống. Đây là tiêu chí chính của cuộc thử nghiệm.
Trong các phân tích định trước trên những bệnh nhân được điều trị trong vòng ba ngày kể từ khi có xuất hiện triệu chứng, hỗn hợp kháng thể này giúp làm giảm nguy cơ tiến triển thành Covid-19 nặng hoặc tử vong (do bất kỳ nguyên nhân nào) tới 88% so với giả dược (khoảng tin cậy 95%, 9-98), và giảm nguy cơ đến 67% (khoảng tin cậy 95%, 31-84) khi người tham gia được tiêm liệu pháp này trong vòng 5 ngày kể từ khi biểu hiện triệu chứng.
Bộ đôi kháng thể này cũng giúp giảm nguy cơ suy hô hấp (tiêu chí phụ) tới 72% (95%, 0,3-92; p = 0,036). Trong đó, chỉ ba bệnh nhân tiêm Evusheld (0,7%) cần được can thiệp bằng các biện pháp thông khí nhân tạo hoặc trao đổi oxy qua màng ngoài cơ thể (ECMO) so với 11 bệnh nhân (33%) dùng giả dược.
Nhìn chung, hỗn hợp kháng thể đơn dòng tác dụng kéo dài này được dung nạp tốt trong các thử nghiệm. Các biến cố ngoại ý diễn ra ở nhóm bệnh nhân dùng giả dược nhiều hơn nhóm được tiêm Evusheld (EV), với tỷ lệ lần lượt là 36% và 29%. Biến cố ngoại ý thường gặp nhất là viêm phổi Covid-19, xảy ra ở 49 bệnh nhân (11%) trong nhóm giả dược và 26 bệnh nhân (6%) trong nhóm EV. Các biến cố ngoại ý nghiêm trọng diễn ra ở 12% bệnh nhân trong nhóm giả dược và 7% bệnh nhân trong nhóm EV1. Có 6 ca tử vong do Covid-19 trong nhóm giả dược và 3 ca trong nhóm EV.
TACKLE là thử nghiệm pha III, ngẫu nhiên, mù đôi, đối chứng với giả dược, đa trung tâm, với mục đích đánh giá tính an toàn và hiệu lực của một liều Evusheld 600mg tiêm bắp duy nhất so với tiêm giả dược để điều trị Covid-19 cho bệnh nhân ngoại trú mức độ nhẹ đến trung bình. Thử nghiệm được tiến hành ở 95 địa điểm ở Mỹ, khu vực Mỹ Latinh, châu Âu và Nhật Bản. 903 người tham gia được phân nhóm ngẫu nhiên (1:1). Trong đó, nhóm 452 người (n = 452) nhận một liều tiêm AZD7442 và nhóm 451 người (n = 451) nhận 1 liều tiêm giả dược nước muối, được thực hiện qua đường tiêm bắp, gồm hai mũi tiêm riêng biệt và tuần tự. Những người tham gia là người lớn từ 18 tuổi trở lên, nhiễm Covid-19 ở mức độ nhẹ đến trung bình, không phải nhập viện và có triệu chứng trong 7 ngày hoặc ít hơn. Những người tham gia có kết quả xét nghiệm khẳng định đã nhiễm SARS-CoV-2, thông qua xét nghiệm phân tử (kháng nguyên hoặc axit nucleic) từ bất kỳ mẫu đường hô hấp nào (ví dụ như dịch hầu họng, mũi họng, phết mũi hoặc nước bọt). Mẫu được thu thập không quá ba ngày trước ngày đầu tiên của thử nghiệm. Người tham gia chưa được tiêm phòng Covid-19 tại thời điểm tiến hành thử nghiệm. Tiêu chí chính đánh giá hiệu lực là tổ hợp của trường hợp mắc Covid-19 nghiêm trọng hoặc tử vong do bất kỳ nguyên nhân nào cho đến ngày thứ 29. Các đối tượng người tham gia sẽ tiếp tục được theo dõi trong 15 tháng.Khoảng 13% người tham gia từ 65 tuổi trở lên. Ngoài ra, 90% người tham gia có bệnh đồng mắc ở thời điểm đánh giá đầu vào và các đặc điểm khác khiến họ có nguy cơ cao tiến triển thành Covid-19 nghiêm trọng, bao gồm ung thư, đái tháo đường, béo phì, bệnh phổi mãn tính hoặc hen suyễn, bệnh tim mạch hoặc suy giảm miễn dịch. Khoảng 62% là người da trắng/gốc Âu, 4% là người da màu/người Mỹ gốc Phi, 6% là người châu Á và 24% là người Mỹ bản địa hoặc người bản địa Alaska. Khoảng 52% người tham gia là người gốc Tây Ban Nha hoặc Mỹ Latinh. |
























.jpg)


.jpg)










