FDA phê chuẩn vaccine phòng ngừa Covid-19 đầu tiên
Bình luận - Ngày đăng : 07:15, 24/08/2021
Đối với người từ 12 - 15 tuổi, vaccine Comirnaty sẽ tiếp tục được cung cấp theo giấy phép sử dụng khẩn cấp (Emergency Use Authorization, EUA).
Thông tin đăng trên trang chính thức của FDA đã trích lời của bác sĩ Janet Woodcock - Quyền Ủy viên FDA: “Việc FDA chấp thuận vaccine này là một cột mốc quan trọng khi chúng ta tiếp tục chiến đấu với đại dịch Covid-19. Mặc dù vaccine này và các loại vaccine khác đã đáp ứng các tiêu chuẩn khoa học nghiêm ngặt của FDA về cấp giấy phép sử dụng khẩn cấp, nhưng với tư cách là vaccine phòng ngừa Covid-19 đầu tiên được FDA phê chuẩn, công chúng có thể tin tưởng rằng Comirnaty đáp ứng các tiêu chuẩn cao về an toàn, hiệu quả và chất lượng sản xuất, theo yêu cầu phê duyệt của FDA.
Đối với một số người, việc FDA chấp thuận vaccine Comirnaty có thể tạo thêm niềm tin để họ quyết định tiêm chủng. Cột mốc quan trọng của ngày hôm nay đưa chúng ta tiến gần hơn một bước tới việc thay đổi diễn biến của đại dịch này ở Hoa Kỳ ”.
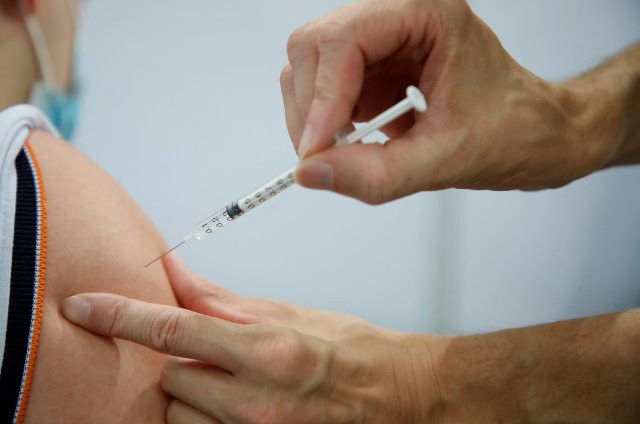 |
Một nhân viên y tế tiêm một liều vaccine Pfizer-BioNTech "Comirnaty" tại Montigny-le-Bretonneux, phía tây nam Paris, Pháp, ngày 13/8/2021. Ảnh: Reuters |
Kể từ ngày 11/12/2020, vaccine Pfizer-BioNTech Covid-19 đã được cung cấp theo EUA cho những người từ 16 tuổi trở lên và EUA đã được mở rộng bao gồm cả những người từ 12 đến 15 tuổi vào ngày 10/5/2021. EUA được FDA sử dụng trong các trường hợp khẩn cấp về sức khỏe cộng đồng, để cung cấp quyền sử dụng các sản phẩm y tế có thể hiệu quả trong việc ngăn ngừa, chẩn đoán hoặc điều trị bệnh khi FDA xác định rằng các lợi ích và tiềm năng đã biết của sản phẩm đó lớn hơn so với rủi ro tiềm ẩn.
Comirnaty là vaccine RNA (mRNA) sử dụng chính mã gene của virus để chống lại virus. mRNA được cơ thể sử dụng để bắt chước một trong những protein của virus gây ra Covid-19. Kết quả của một người nhận vaccine này là hệ thống miễn dịch của họ cuối cùng sẽ phản ứng phòng thủ với virus gây ra Covid-19.
mRNA trong Comirnaty chỉ tồn tại trong cơ thể một thời gian ngắn và không được kết hợp vào, cũng như không thay đổi vật chất di truyền của một cá nhân. Comirnaty có công thức tương tự như vaccine Pfizer-BioNTech đã có EUA và được chỉ định tiêm chủng 2 liều, mũi 1 cách mũi 2 ba tuần.
Để được cấp phép sử dụng đầy đủ, các thông tin về vaccine phải được đệ trình lên FDA trong bộ hồ sơ được gọi là “Đơn xin cấp phép sinh học” (biologics license application, gọi tắt là BLA), bao gồm các nội dung yêu cầu rất cụ thể.
Đối với trường hợp vaccine Comirnaty, hồ sơ BLA được viết dựa trên các dữ liệu đã gửi trước đó khi xin giấy phép sử dụng khẩn cấp nhưng mở rộng thêm với các dữ liệu lâm sàng với thời gian theo dõi dài hơn, các kết quả mới tiền lâm sàng, cũng như chi tiết về quy trình sản xuất, kết quả kiểm tra chất lượng vaccine và kết quả thanh tra các cơ sở sản xuất vaccine.
Ngoài ra, dựa trên hồ sơ BLA, FDA cũng đã tự tiến hành các phân tích để bảo đảm vaccine an toàn, hiệu quả và đáp ứng các tiêu chuẩn của khắc khe của FDA.
Cụ thể, trong quá trình xem xét phê duyệt của FDA, cơ quan này đã phân tích dữ liệu hiệu quả từ khoảng 20.000 người được chích vaccine và 20.000 người nhận giả dược từ 16 tuổi trở lên, tất cả đều không bị nhiễm virus Covid-19 trong vòng 1 tuần sau khi nhận liều thứ hai.
Tính an toàn của Comirnaty đã được đánh giá ở khoảng 22.000 người đã chích vaccine và 22.000 người nhận giả dược từ 16 tuổi trở lên. Dựa trên kết quả từ thử nghiệm lâm sàng, vaccine này có hiệu quả 91% trong việc ngăn ngừa bệnh Covid-19.
Hơn một nửa số người tham gia thử nghiệm lâm sàng được theo dõi sự an toàn trong ít nhất 4 tháng sau khi chích liều thứ 2. Nhìn chung, khoảng 12.000 người chích vaccine đã được theo dõi sức khỏe ít nhất trong 6 tháng.
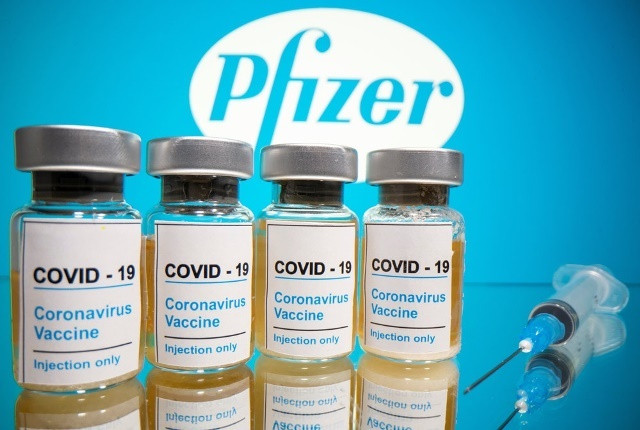 |
FDA tuyên bố vaccine Comirnaty của hãng Pfizer-BioNTech có hiệu quả 91% trong việc ngăn ngừa bệnh Covid-19 |
Những tác dụng phụ được báo cáo phổ biến nhất từ số người tham gia thử nghiệm lâm sàng Comirnaty là đau, đỏ và sưng tại chỗ tiêm, mệt mỏi, nhức đầu, đau cơ hoặc khớp, ớn lạnh và sốt.
Ngoài ra, tác dụng phụ nguy hiểm hiếm gặp của vaccine này liên quan đến viêm cơ tim và viêm màng ngoài tim (myocarditis and pericarditis) chủ yếu trong vòng 7 ngày sau khi chích liều thứ 2. Nguy cơ này cao hơn ở nam giới dưới 40 tuổi so với nữ giới và nam giới lớn tuổi hơn và cao nhất ở nam giới từ 12 đến 17 tuổi. Tất cả các trường hợp này đều đã hồi phục và thông tin này được ghi rõ trong phần cảnh báo nguy cơ của vaccine.
FDA yêu cầu công ty Pfizer-BioNTech thực hiện các nghiên cứu sau khi đưa ra thị trường để đánh giá thêm các nguy cơ viêm cơ tim và viêm màng ngoài tim sau khi tiêm vaccine Comirnaty. Những nghiên cứu này bao gồm việc theo dõi sức khỏe những người bị viêm cơ tim sau khi tiêm vaccine Comirnaty.
Ngoài ra, mặc dù không phải là yêu cầu của FDA, công ty Pfizer-BioNTech đã cam kết thực hiện các nghiên cứu an toàn bổ sung sau khi tiếp thị, bao gồm thực hiện một nghiên cứu trên phụ nữ mang thai để đánh giá kết quả sau khi họ được chích Comirnaty trong thai kỳ.
FDA là cơ quan thuộc Bộ Y tế và Dịch vụ Nhân sinh Hoa Kỳ, bảo vệ sức khỏe cộng đồng bằng cách bảo đảm tính an toàn, hiệu quả của các loại thuốc thú y và con người, vaccine và các sản phẩm sinh học khác dùng cho con người và các thiết bị y tế.
Cơ quan này cũng chịu trách nhiệm về sự an toàn và an ninh của nguồn cung cấp thực phẩm, mỹ phẩm, thực phẩm chức năng, các sản phẩm phát ra bức xạ điện tử và điều chỉnh các sản phẩm thuốc lá của Hoa Kỳ.
